Đề kiểm tra học kì I môn Hóa học Lớp 8 - Tiết 36 - Năm học 2019-2020 (Có đáp án)
Câu 8. Hiện tượng sau đây là hiện tượng hoá học:
A. Thuỷ tinh khi đun nóng đỏ uốn cong được B. Khi nung nóng, nến chảy lỏng rồi thành hơi;
C. Thanh sắt để lâu ngoài không khí bị gỉ; D.Cồn để trong lọ không đậy kín bị bay hơi;
Câu 9. Hỗn hợp nào dưới đây có thể tách riêng các chất, bằng cách cho hỗn hợp vào nước sau đó khuấy kỹ và lọc:
A. Đường và muối ăn. B. Bột than và bột sắt.
C. Bột đá vôi và muối ăn. D. Giấm và rượu
Bạn đang xem tài liệu "Đề kiểm tra học kì I môn Hóa học Lớp 8 - Tiết 36 - Năm học 2019-2020 (Có đáp án)", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
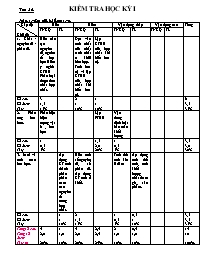
Tiết 36: KIỂM TRA HỌC KỲ I Ma trân đề kiểm tra Cấp độ Chủ đề Biết Hiểu Vận dụng thấp Vận dụng cao Tổng TNKQ TL TNKQ TL TNKQ TL TNKQ TL 1. Chất - nguyên tử - phân tử. Biết cấu tạo nguyên tử, nguên tố hoá học Hiểu ý nghĩa CTHH Phân loại được đơn chất hợp chất. Dựa vào tính chất của chất tách chất ra khỏi hỗn hợp. Tính hoá trị và lập CTHH của hợp chất khi biết hoá trị. Lập CTHH của hợp chất khi biết hoá trị. Số câu Số điểm Tỉ lệ 3 1,5 15% 2 1 10% 1 1 10% 6 3,5 35% 2. Phản ứng hoá hoc. Phân biệt hiện tượng vật lí , hóa học Lập PTHH Vận dung định luật bảo toàn khối lượng Số câu Số điểm Tỉ lệ 1 0,5 5% 1,5 2,0 20% 1 0,5 5% 3,5 3,0 30% 3. Mol và tính toán hoá học. Áp dụng CT tính thành phần phần trăm các nguyên tố trong hợp chất. Biết tính số nguyên tử, số phân tử. Áp dụng CT tính tỉ khối. Tính thể tích khí ở đktc Áp dụng tính thể tích, tính khối lượng chất tham gia, sản phẩm. Số câu Số điểm Tỉ lệ 1 1 10% 2 1,5 15% 1 0,5 5% 0,5 1 10% 3,5 3,5 35% Tổngsố câu Tổng số điểm Tỉ lệ % 4 2,0 20% 1 1,0 10% 4 2,0 20% 2,5 2,5 25% 2 1,0 10% 0,5 1,0 10% 14 10 100% PHÒNG GD-ĐT KIỂM TRA HỌC KÌ I NĂM HỌC : 2019-2020 Họ và tên : . . . . . . . . . . . . . . . . . . . . MÔN : HÓA HỌC 8 Thời gian làm bài : 45 phút Điểm Chữ kí giám khảo Mã phách Bằng số Bằng chữ Giám khảo 1 Giám khảo 2 I. PHẦN TRẮC NGHIỆM KHÁCH QUAN ( 05 điểm): Hãy khoanh tròn chữ cái A hoặc B, C, D đứng trước câu trả lời đúng Câu 1. Hạt nhân nguyên tử cấu tạo bởi: A. Proton và electron B. Proton và nơtron C. Nơtron và electron D. Proton, nơtron và electron. Câu 2. Cách viết nào sau đây chỉ 3 nguyên tử Oxi. A. O3 B. 3O2 C. 3O D. 3O2 Câu 3. Nhóm chất nào sau đây toàn đơn chất. A. Na, Ca, Cu, Br2. B. Na, Ca, CO, Cl2 C. CaO, H2O, CuO, HCl .D. Cl2, O2, CO2, N2. Câu 4. CTHH của hợp chất nguyên tố R với nhóm SO4(II) là R2(SO4)3. CTHH của hợp chất nguyên tố R với clo là: A. RCl B. RCl2 C. RCl3 D. RCl4 Câu 5. Cho 3,6 gam kim loại magie tác dụng vừa hết với 210 gam dung dịch axit clohidric và thoát ra 0,3 gam khí hidro. Khối lượng dung dịch magie clorua (MgCl2) sinh ra là: A. 213g B. 213,3g C. 214,4g D. 214g Câu 6. Chất khí A có CTHH của A là: A. SO B. CO2 C. N2 D. NH3 Câu 7. Số phân tử của 14 gam khí nitơ là: A. 6. 1023 B. 1,5. 1023 C. 9. 1023 D. 3.1023 Câu 8. Hiện tượng sau đây là hiện tượng hoá học: A. Thuỷ tinh khi đun nóng đỏ uốn cong được B. Khi nung nóng, nến chảy lỏng rồi thành hơi; C. Thanh sắt để lâu ngoài không khí bị gỉ; D.Cồn để trong lọ không đậy kín bị bay hơi; Câu 9. Hỗn hợp nào dưới đây có thể tách riêng các chất, bằng cách cho hỗn hợp vào nước sau đó khuấy kỹ và lọc: A. Đường và muối ăn. B. Bột than và bột sắt. C. Bột đá vôi và muối ăn. D. Giấm và rượu Câu 10. 1 mol khí CO2 ở đktc có thể tích là: A. 22,4 lít B. 33,6 lít C. Không xác định được D. 11,2 lít II. PHẦN TỰ LUẬN (05 điểm): Câu 1.(1đ) Lập CTHH của hợp chất gồm các nguyên tố sau: a. Na (I) và nhóm SO4(II) b. Lưu huỳnh (VI) và oxi. Câu 2 . (1đ) Tính thành phần phần trăm của Cu trong các hơp chất: CuO Câu 3 .(1,5đ) Lập PTHH sau: 1. P + O2 → P2O5 2. Fe + HCl ® FeCl2 + H2 3. Fe + O2 ® Fe3O4 Câu 4.(1.5đ). Cho 3,2 gam lưu huỳnh cháy trong khí oxi sau phản ứng thu được khí sunfurơ (SO 2 ) a. Lập phương trình phản ứng? b. Tính khối lượng oxi tham gia phản ứng và thể tích SO2 sinh ra ở (đktc). Cho biết : S =32 ; O2 =16 Đáp án - Biểu điểm. I. PHẦN TRẮC NGHIỆM KHÁCH QUAN (05 điểm): Câu 1 2 3 4 5 6 7 8 9 10 Đáp án B B A C B C D C C A II. PHẦN TỰ LUẬN (05 điểm): Câu 1. (1 điểm) a. Na2SO4 b. SO2 (Mỗi CTHH đúng được 0,5 điểm.) Câu 2. (1 điểm) MCuO = 64 + 16 = 80g (0,5 điểm.) % Cu = 80% (0,5 điểm.) Câu 3.(1,5 điểm ) PTHH 1. 2P + 5O2 → 2P2O5 2. Fe + 2HCl ® FeCl2 + H2 3. 3Fe + 2O2 ® Fe3O4 (Mỗi PTHH đúng được 0,5 điểm.) Câu 4.( 1,5 đ ) . S + O2 → SO2 (0,5 điểm ) Số mol S nS = = 0,1 mol (0,25 điểm ) Theo PTHH : số mol SO2 = số mol S = số mol O2 = 0,1 mol (0,25 điểm ) Thể tích SO2 sinh ra ở (đktc ) : 0,1.22,4 = 2,24 lít (0,25 điểm ) Khối lượng oxi : 32 .0,1 =3,2 g (0,25 điểm )
Tài liệu đính kèm:
 de_kiem_tra_hoc_ki_i_mon_hoa_hoc_lop_8_tiet_36_nam_hoc_2019.doc
de_kiem_tra_hoc_ki_i_mon_hoa_hoc_lop_8_tiet_36_nam_hoc_2019.doc






