Đề kiểm tra học kì 2 môn Hóa học Lớp 8 - Năm học 2018-2019 (Có đáp án)
Câu 4: (2Đ)
Cho 2,7g Al tác dụng với dung dịch HCl 2M ( vừa đủ )
a. Tính thể tích khí thoát ra (đktc)?
b. Tính nồng độ mol của chất có trong dung dịch sau khi phản ứng kết thúc?
( cho: Al = 27, H = 1, Cl = 35,5 )
Bạn đang xem tài liệu "Đề kiểm tra học kì 2 môn Hóa học Lớp 8 - Năm học 2018-2019 (Có đáp án)", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
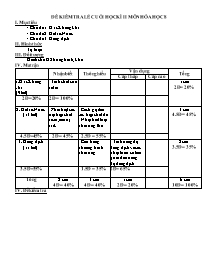
ĐỀ KIỂM TRA LẺ CUỐI HỌC KÌ II MÔN HÓA HỌC 8 I. Mục tiêu: - Chủ đề 1: Oxi. Không khí - Chủ đề 2: Hiđrô. Nước - Chủ đề 3: Dung dịch II. Hình thức: Tự luận III. Đối tượng: Dành cho HS trung bình, khá IV. Ma trận: Nhận biết Thông hiểu Vận dụng Tổng Cấp thấp Cấp cao 1.Oxi. Không khí (9 tiết) - Tính chất của hiđrô 1câu 2Đ = 20% 2Đ=20% 2Đ = 100% 2. Hiđrô. Nước (13 tiết) - Phân biệt các loại hợp chất bazơ,muối, axit. - Cách gọi tên các hợp chất đó - Nhận biết loại phản ứng thế 3 câu 4.5Đ = 45% 4.5Đ=45% 2Đ = 45% 2.5Đ = 55% 3. Dung dịch (11 tiết) - Cân bằng phương trình phản ứng - Tính nồng độ dung dịch và các phép toán có liên quan đến nồng độ dung dịch 2 câu 3.5Đ = 35% 3.5Đ=35% 1.5Đ = 35% 2Đ= 65% Tổng 2 câu 4Đ = 40% 3 câu 4Đ = 40% 1câu 2Đ = 20% 6 câu 10Đ = 100% IV. Đề kiểm tra ĐỀ KIỂM TRA HỌC KÌ II (Năm học: 2018 - 2019) MÔN HÓA HỌC LỚP 8 Thời gian: 60 phút (Không kể thời gian giao đề) Họ và tên học sinh.. Lớp:...Trường:. Số báo danh:.. Giám thị 1: Giám thị 2: Số phách: Đề lẻ Điểm Chữ ký giám khảo Số phách ĐỀ: Câu 1: Trình bày tính chất hóa học của hiđrô, mỗi tính chất viết phương trình phản ứng minh họa? (2Đ) Câu 2: (2Đ) a. Hoàn thành các phương trình phản ứng sau: (1.5Đ) A. Fe + H2SO4 à Fe2(SO4)3 + H2 B. Al(OH)3 à Al2O3 + H2O C. Cu + O2 à CuO b. Trong các phản ứng trên, phản ứng nào thuộc loại phản ứng thế? (0.5Đ) Câu 3: (4Đ) a. Trong các hợp chất sau, hợp chất nào thuộc loại axit, bazơ, muối? 2Đ) H2SO4, Ba(OH)2, CuSO4, ZnCl2, Fe(OH)3, HBr, Ca(NO3)2, HCl b. Hãy đọc trên các hợp chất trên? (2Đ) Câu 4: (2Đ) Cho 2,7g Al tác dụng với dung dịch HCl 2M ( vừa đủ ) a. Tính thể tích khí thoát ra (đktc)? b. Tính nồng độ mol của chất có trong dung dịch sau khi phản ứng kết thúc? ( cho: Al = 27, H = 1, Cl = 35,5 ) V.Đáp án: Câu Đáp án Điểm 1 Tính chất hóa học của hiđrô: a. Tác dụng với oxi: 2H2 + O2 à 2H2O b. Tác dụng với đồng (II) oxit: CuO + H2 à Cu + H2O 2Đ 2 a. Hoàn thành các phương trình phản ứng sau: A. 2Fe + 3H2SO4 à Fe2(SO4)3 + 3H2 B. 2 Al(OH)3 à Al2O3 + 3H2O C. 2Cu + O2 à 2CuO b. Trong các phản ứng trên, phản ứng A thuộc loại phản ứng thế. 0,5 x 3 = 1.5 Đ 0.5Đ 3 a. - Axit: H2SO4, HBr, HCl - Bazơ: Ba(OH)2, Fe(OH)3 - Muối: CuSO4, ZnCl2, CaCl2 b. - H2SO4: Axit sunfuric - Ba(OH)2: Bari hiđrôxit - CuSO4: Đồng (II) sunfat - ZnCl2: Kẽm clorua - Fe(OH)3: Sắt (III) hiđrôxit - HBr: Axit brômhiđric - Ca(NO3)2: Canxi nitrat - HCl: Axit clohiđric 0.25 x 8 = 2Đ 0.25 x 8 = 2Đ 4 a. Phương trình phản ứng xảy ra: 2Al + 6HCl à 2AlCl3 + 3H2 2 mol 6 mol 2 mol 3 mol 0.1 mol y mol z mol x mol 2,7 27 Số mol Al: nAl = = 0,1 (mol) 0,1 x 3 2 Số mol H2: nH2= x = = 0,15 (mol) Thể tích H2 (đktc): VH2 = 0,15 x 22,4 = 3,36 (l) 0,1 x 6 2 b. Số mol HC: nHCl = y= = 0.3 ( mol ) 0,3 2 Thể tích dung dịch HCl: V dd HCl = = 0,15 (l) 0,1 x 2 2 Số mol AlCl3: n AlCl3 = z = = 0,1 (mol) 0,1 0,15 Nồng độ mol của dung dịch AlCl3: CM= = 0,66 (M) 0.5Đ 1.5Đ
Tài liệu đính kèm:
 de_kiem_tra_hoc_ki_2_mon_hoa_hoc_lop_8_nam_hoc_2018_2019_co.doc
de_kiem_tra_hoc_ki_2_mon_hoa_hoc_lop_8_nam_hoc_2018_2019_co.doc






