Kiểm tra học kỳ II môn: Hoá học 9 - Trường PTDT Nội trú Văn Lang
I/ Mục tiêu:
1. Kiến thức:
- Chủ đề 1: Tính chất và cách điều chế các hiđrocacbon (metan, etilen, axetilen)
- Chủ đề 2: Tính chất và cách điều chế các dẫn xuất của hiđrocacbon (rượu etylic, axit axetic, chất béo)
- Chủ đề 3: Mối liên hệ giữa các chất hữu cơ
2. Kỹ năng:
- Có kỹ năng viết CTCT, PTHH của các chất hữu cơ.
- Nhận biết các chất.
- Giải bài tập tính theo PTHH, tính khối lượng chất khi biết hiệu suất phản ứng.
3. Thái độ:
- Cẩn thận, nghiêm túc khi làm bài
II/ Hình thức kiểm tra: Tự luận
Bạn đang xem tài liệu "Kiểm tra học kỳ II môn: Hoá học 9 - Trường PTDT Nội trú Văn Lang", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
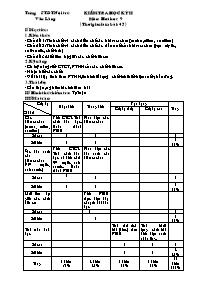
Tr ường PTDT Nội trú kiểm tra học kỳ ii Văn Lãng môn: Hoá học 9 (Thời gian làm bài: 45') I/ Mục tiêu: 1. Kiến thức: - Chủ đề 1: Tính chất và cách điều chế các hiđrocacbon (metan, etilen, axetilen) - Chủ đề 2: Tính chất và cách điều chế các dẫn xuất của hiđrocacbon (rượu etylic, axit axetic, chất béo) - Chủ đề 3: Mối liên hệ giữa các chất hữu cơ 2. Kỹ năng: - Có kỹ năng viết CTCT, PTHH của các chất hữu cơ. - Nhận biết các chất. - Giải bài tập tính theo PTHH, tính khối lượng chất khi biết hiệu suất phản ứng. 3. Thái độ: - Cẩn thận, nghiêm túc khi làm bài II/ Hình thức kiểm tra: Tự luận III/ Ma trận: Cấp độ Chủ đề Nhận biết Thông hiểu Vận dụng Tổng Cấp độ thấp Cấp độ cao Các hiđrocacbon (metan, etilen, axetilen) Viết CTCT. Tính chất hóa học. Hoàn thành PTHH Phân biệt các hiđrocacbon Số câu 1 1 2 Số điểm 1 1 2 20% các dẫn xuất của hiđrocacbon (rượu etylic, axit axetic) Viết CTCT. Tính chất hóa học và điều chế rượu etylic, axit axetic. Hoàn thành PTHH Phân biệt các dẫn xuất của hiđrocacbon Số câu 1 1 2 Số điểm 1 1 2 20% Mối liên hệ giữa các chất hữu cơ Viết PTHH thực hiện dãy chuyển đổi hóa học Số câu 1 1 Số điểm 2 2 20% Tính toán hoá học Tính thể tích khí (đktc) theo PTHH Tính khối lượng chất khi biết hiệu suất phản ứng. Số câu 1 1 2 Số điểm 2 2 4 40% Tổng 2 điểm 30% 4 điểm 40% 2 điểm 20% 2 điểm 20% 10 điểm 100% IV/ Đề bài: Câu 1: (2 điểm) Viết công thức cấu tạo của các chất có công thức phân tử sau: C2H6O ; C2H2 ; C3H7Cl ; C4H8 Câu 2: (2 điểm) Bằng phương pháp hoá học hãy phân biệt: a) Các chất lỏng: Rượu etylic, axit axetic, glucozơ. b) Các khí: metan, cacbon đioxit, axetilen. Câu 3: (2 điểm): Viết PTHH thực hiện dãy biến hoá sau: C2H4 C2H5OH CH3COOH CH3COO C2H5 CH3COONa Câu 4: (2 điểm) Đốt cháy hoàn toàn 4,48l CH4 trong khí oxi. Tính thể tích khí O2 cần dùng và thể tích khí CO2 thu được. (Thể tích các khí đo ở đktc). Câu 5: (2 điểm) Cho 30 gam axit axetic tác dụng với rượu etylic dư (có axit H2SO4 đặc làm chất xúc tác, đun nóng) thu được etyl axetat CH3COOC2H5 . Tính khối lượng etyl axetat thu được, nếu hiệu suất phản ứng là 85%. ( Biết C = 12; H = 1; O = 16) V/ Đáp án Câu 1 : (2 điểm): Viết được mỗi công thức cấu tạo được 0,5 điểm: C2H6O: CH3 - CH2 -OH hay CH3 - O - CH3 C2H4O2: CH2 = CH2 C3H7Cl : CH3 - CH2 - CH2 - Cl C4H8 : H2C CH2 H2C CH2 Câu 2: (2 điểm): Phân biệt các chất: a) Các chất lỏng: Rượu etylic, axit axetic, glucozơ. - Dùng quỳ tím phân biệt được axit axetic do làm quỳ tím chuyển màu đỏ. - Dùng dd AgNO3 trong môi trường NH3 nhận ra glucozơ, chất còn lại không phản ứng là rượu etylic. C6H12O6 + Ag2O dd NH3 C6H12O7 + 2Ag b) Các khí: metan, cacbon đioxit, axetilen. - Dùng nước vôi trong: Nhận ra cacbon đioxit do làm nước vôi trong vẩn đục - Dùng dung dịch brôm màu da cam: Khí làm mất màu dung dịch brôm là axetilen. Chất còn lại không phản ứng là metan. CO2 + Ca(OH)2 CaCO3 + H2O C2H2 + 2Br2 C2H2Br4 Câu 3: (2 điểm) mỗi PTHH viết đúng được 0,5đ C2H4 + H2O axit C2H5OH C2H5OH + O2 Men giấm CH3COOH + H2O H2SO4 đ, to CH3COOH + C2H5OH CH3COO C2H5 + H2O CH3COOC2H5 + NaOH tº CH3COONa + C2H5OH Câu 4: (2 điểm) a) Tính được số mol CH4 = 4,48 : 22,4 = 0, 2(mol) (0,5đ) to PTHH: CH4 + 2O2 CO2 + 2H2O (0,5đ) b) Theo PT: nO2 = 2 nCH4 = 0,2 x 2 = 0,4 mol nCO2 = nCH4 = 0,2 mol Thể tích oxi cần dùng là: VO2 = nO2 x 22,4 = 0,4 x 22,4 = 8,96 (l) (0,5đ) Thể tích khí cacbonic thu được là: VCO2 = nCO2 x 22,4 = 0,2 x 22,4 = 4,48 (l) (0,5đ) Câu 6: (2 điểm) a) Tính được số mol CH3COOH = 30 : 60= 0,5 (mol) (0,25đ) H2SO4 đ, to CH3COOH + C2H5OH CH3COO C2H5 + H2O(0,5đ) nCH3COO C2H5 = nCH3COOH = 0,5 mol (0,25đ) Khối lượng etyl axetat thu được là: mCH3COO C2H5 = 0,5 x 88 = 44 (g) (0,5đ) Vì hiệu suất phản ứng là 85% nên khối lượng etyl axetat thu được là: 44 x 90 mCH3COO C2H5 = = 39,6 (g) (0,5đ) 100 Họ và tên.............................. kiểm tra 1 tiết Môn: Hoá học 9 Câu 1 : (2 điểm): Viết các công thức cấu tạo dạng rút gọn ứng với mỗi công thức phân tử sau: C2H6O (2công thức); C2H4O2 (1 CT); C4H9Cl (1CT) Câu 2: (2 điểm) Cho các chất sau: Na, NaOH, H2, H2O, C2H5OH, CH3COOH, Zn, ZnO. Hãy chọn các chất phù hợp điền vào chỗ trống và hoàn thành các phương trình hoá học sau: a) C2H5OH + ........... C2H5ONa + ..........↑ Men giấm b) C2H5OH + O2 ................. + H2O c) CH3COOH + KOH CH3COOK + ........... d) CH3COOH + ............... (CH3COO)2Zn + H2↑ Câu 3: (1 điểm) Chỉ dùng nước và quỳ tím hãy trình bày cách phân biệt 3 chất lỏng: Rượu etylic, axit axetic, chất béo. Câu 4: (2 điểm) Đốt cháy hoàn toàn 4,6 gam r ượu etylic. Tính thể tích khí O2 cần dùng và thể tích khí CO2 tạo ra ở đktc. Câu 5: (3 điểm) Cho 30 gam axit axetic tác dụng với rượu etylic dư (có axit H2SO4 đặc làm chất xúc tác, đun nóng) thu được etyl axetat CH3COOC2H5 . Tính khối lượng etyl axetat thu được, nếu hiệu suất phản ứng là 90%. ( Biết C = 12; H = 1; O = 16) Bài làm ...................................................................................................................................... ............................................................................................................................................................................................................................................................................ ............................................................................................................................................................................................................................................................................ ............................................................................................................................................................................................................................................................................ ............................................................................................................................................................................................................................................................................ ............................................................................................................................................................................................................................................................................ ............................................................................................................................................................................................................................................................................
Tài liệu đính kèm:
 DE KT hoc ki II hay Hoa 9.doc
DE KT hoc ki II hay Hoa 9.doc





