Giáo án Hóa học 8 - Năm 2011 - Tiết 36: Kiểm tra học kì I
I. MỤC TIÊU ĐỀ KIỂM TRA
1. Kiến thức
- Chủ đề 1: Chương I. Chất – nguyên tử - phân tử (14 tiết)
- Chủ đề 2: Chương II. Phản ứng hoá học. (6 tiết)
- Chủ đề 3: Chương III. Mol và tính toán hoá học. (9 tiết)
2. Kỹ năng
- Trả lời câu hỏi tự luận.
- Viết, lập công thức hoá học, phương trình hoá học, cân bằng PTHH.
- Tính toán theo phương trình hoá học.
3. Thái độ
- Xây dựng lòng tin và tính quyết đoán khi làm bài KT.
- Có thái độ nghiêm túc trong kiểm tra đánh giá bản thân.
Bạn đang xem tài liệu "Giáo án Hóa học 8 - Năm 2011 - Tiết 36: Kiểm tra học kì I", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
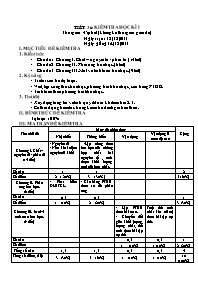
TiÕt 36: KIỂM TRA HỌC KÌ I Thời gian: 45 phút (không kể thời gian giao đề) Ngµy so¹n: 12/12/2011 Ngµy gi¶ng 14/12/2011 I. MỤC TIÊU ĐỀ KIỂM TRA 1. Kiến thức Chủ đề 1: Chương I. Chất – nguyên tử - phân tử (14 tiết) Chủ đề 2: Chương II. Phản ứng hoá học. (6 tiết) Chủ đề 3: Chương III. Mol và tính toán hoá học. (9 tiết) 2. Kỹ năng - Trả lời câu hỏi tự luận. - Viết, lập công thức hoá học, phương trình hoá học, cân bằng PTHH. - Tính toán theo phương trình hoá học. 3. Thái độ - Xây dựng lòng tin và tính quyết đoán khi làm bài KT. - Có thái độ nghiêm túc trong kiểm tra đánh giá bản thân. II. HÌNH THỨC ĐỀ KIỂM TRA Tự luận 100% III. MA TRẬN ĐỀ KIỂM TRA Tên chủ đề Mức độ nhận thức Cộng Nhận biết Thông hiểu Vận dụng Vận dụng ở mức độ cao Chương I. Chất – nguyên tử - phân tử (14 tiết) - Nguyên tử - Nêu khái niệm nguyên tử khối -Lập công thức hoá học của những hợp chất hai nguyên tố , tính được khối lượng mol của hợp chất. Số câu 1 1 2 Số điểm 2 ( 20%) 3 ( 30% ) 5 (50%) Chương II. Phản ứng hoá học. (6 tiết) - Phát biểu ĐLBTKL. - Cân bằng PTHH theo sơ đồ phản ứng Số câu 0,5 0,5 1 Số điểm 1 (10%) 2 (20%) 3 (30%) Chương III. Mol và tính toán hoá học. (9 tiết) - Lập PTHH theo bài toán. - Chuyển đổi giữa khối lượng, lượng chất, thể tích theo bài tập cụ thể Tính thể tích chất khí (đktc) theo bài tập cụ thề. Số câu 0,5 0,5 1 Số điểm 1 (10%) 1 (10%) 2 (20%) Tổng số câu 1,5 1,5 0,5 0,5 4 Tổng số điểm, tỉ lệ 3 (30%) 5 (50%) 1 (10%) 1 (10%) 10 (100%) C©u 1 ( 2 điểm): TÝnh thµnh phÇn phÇn tr¨m theo khèi lîng cña c¸c nguyªn tè trong hîp chÊt Ca(NO3)2 Câu 2 ( 3 điểm): Lập công thức hoá học hợp chất sau: Hợp chất A có thành phần : 7 phần khối lượng sắt kết hợp với 3 phần khối lượng oxi. Cho biết khối lượng mol phân tử của hợp chất đó. Hợp chất khí B có thành phần phần trăm theo khối lượng là 82,35% N và 17,65% H. Tỉ khối của khí B so với Hiđro là 8,5. Câu 3 ( 3 điểm): a. Phát biểu ĐLBTKL (1đ) b. Cân bằng các PTHH theo sơ đồ phản ứng sau: (2đ) HgO ------ > Hg + O2 Zn + HCl ------ > ZnCl2 + H2 FexOy + HCl ------ > FeCl2y/x + H2O Câu 4 ( 2 điểm): Đốt cháy 1,6 g lưu huỳnh trong không khí thu được khí lưu huỳnh đioxit (SO2). A, Viết phương trình hoá học của phản ứng. (0,5đ) B,Tính thể tích khí lưu huỳnh đioxit sinh ra ở đktc. (1,5đ) ĐỀ BÀI: C©u 1 ( 2 điểm): TÝnh thµnh phÇn phÇn tr¨m theo khèi lîng cña c¸c nguyªn tè trong hîp chÊt Ca(NO3)2 Câu 2 ( 3 điểm): Lập công thức hoá học hợp chất sau: Hợp chất A có thành phần : 7 phần khối lượng sắt kết hợp với 3 phần khối lượng oxi. Cho biết khối lượng mol phân tử của hợp chất đó. Hợp chất khí B có thành phần phần trăm theo khối lượng là 82,35% N và 17,65% H. Tỉ khối của khí B so với Hiđro là 8,5. Câu 3 ( 3 điểm): a. Phát biểu ĐLBTKL (1đ) b. Cân bằng các PTHH theo sơ đồ phản ứng sau: (2đ) HgO ------ > Hg + O2 Zn + HCl ------ > ZnCl2 + H2 FexOy + HCl ------ > FeCl2y/x + H2O Câu 4 ( 2 điểm): Đốt cháy 1,6 g lưu huỳnh trong không khí thu được khí lưu huỳnh đioxit (SO2). A, Viết phương trình hoá học của phản ứng. (0,5đ) B,Tính thể tích khí lưu huỳnh đioxit sinh ra ở đktc. (1,5đ) HƯỚNG DẪN CHẤM VÀ BIỂU ĐIỂM Câu 1: ( 2điểm) a) Nguyên tử là hạt vô cùng nhỏ, trung hoà về điện. Gồm hạt nhân mang điện tích dương và vỏ là các electron mang điện tích âm. (0,5đ) b) Nêu khái niệm nguyên tử khối:Là khối lượng của nguyên tố tính bằng đơn vị cacbon. Mổi nguyên tố có nguyên tử khối riêng biệt. (1đ) Ví dụ: Nguyên tử khối của hidro là 1 đvC. (0,25đ) Nguyên tử khối của oxi là 16 đvC. (0,25đ) Câu 2: ( 3 diiểm) a) Lập được công thức hoá học và tính khối lượng mol phân tử của hợp chất: Fe2O3 MFe2O3 = 160 g ( 1,5 điểm) b) Lập công thức hoá học của hợp chất NH3 ( 1,5 điểm) Câu 3: ( 3 điểm) a) Phát biểu ĐLBTKL: Trong một phản ứng hoá học, tổng khối lượng của các chất sản phẩm bằng tổng khối lượng của các chất tham gia phản ứng (1đ) b) Cân bằng các PTHH theo sơ đồ phản ứng: 2HgO → 2Hg + O2 (0,5đ) Zn + 2HCl → ZnCl2 + H2 (0,5đ) FexOy + 2yHCl xFeCl2y/x + yH2O ( 1điểm) Câu 5: ( 2điểm) Đốt cháy 1,6 g lưu huỳnh trong không khí thu được khí lưu huỳnh đioxit (SO2). Viết phương trình hoá học của phản ứng.. S + O2 → SO2 (0,25đ) Tính thể tích khí lưu huỳnh đioxit sinh ra ở đktc. Số mol của lưu huỳnh: (0,25đ) nS = mS : MS = 1,6 : 32 = 0,25 (mol) (0,5đ) PTHH có tỉ lệ số mol là 1:1: 1 nên ta có số mol các chất bằng nhau và bằng 0,05 mol [Hoặc theo PTHH ta có = nS = 0,05 (mol)] (0,25đ) Thể tích khí thu được ở đkc là: (0,25d) V = n x 22,4 = 0,05 x 22,4 = 1,12 (lit) (0,5đ) (HS giải cách khác đúng vẫn đạt điểm tối đa)
Tài liệu đính kèm:
 BO DE KIEM TRA HOA 8 CO MA TRAN.doc
BO DE KIEM TRA HOA 8 CO MA TRAN.doc





