Đề kiểm tra giữa học kì 2 Hóa học Lớp 8 - Năm học 2020-2021
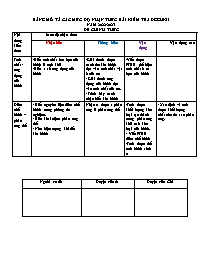
Nội dung kiến thức Mức độ nhận thức
Nhận biết Thông hiểu Vận dụng Vận dụng cao
Tính chất - ứng dụng của hiđrô -Biết tính chất hóa học của hiđrô là tính khử
-Biết 1 số ứng dụng của hiđrô -Giải thích được cách thu khí hiđrô dựa vào tính chất vật lí của nó
- Giải thích ứng dụng của hiđrô dựa vào tính chất của nó.
- Trình bày cách nhận biết khí hiđrô -Viết được PTHH thể hiện tính chất h óa học của hiđrô
Bạn đang xem tài liệu "Đề kiểm tra giữa học kì 2 Hóa học Lớp 8 - Năm học 2020-2021", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
BẢNG MÔ TẢ CÁC MỨC ĐỘ NHẬN THỨC BÀI KIỂM TRA ĐGGHKII NĂM 2022-2023 ĐỀ CHÍNH THỨC Nội dung kiến thức Mức độ nhận thức Nhận biết Thông hiểu Vận dụng Vận dụng cao Tính chất - ứng dụng của hiđrô -Biết tính chất hóa học của hiđrô là tính khử -Biết 1 số ứng dụng của hiđrô -Giải thích được cách thu khí hiđrô dựa vào tính chất vật lí của nó - Giải thích ứng dụng của hiđrô dựa vào tính chất của nó. - Trình bày cách nhận biết khí hiđrô -Viết được PTHH thể hiện tính chất h óa học của hiđrô Điều chế hiđrô – phản ứng thế - Biết nguyên liệu điều chế hiđrô trong phòng thí nghiệm. - Biết khái niệm phản ứng thế - Nêu hiện tượng khi đốt khí hiđrô Nhận ra được 1 phản ứng là phản ứng thế -Tính được khối lượng kim loại tạo thành trong phản ứng khử oxit kim loại của hiđrô. - Viết PTHH điều chế hiđrô -Tính được thể tích hiđrô sinh ra - Xác định và tính được khối lượng chất còn dư sau phản ứng. Người ra đề Duyệt của tổ Duyệt của CM MA TRẬN ĐỀ KIỂM TRA ĐGGHKII NĂM 2022-2023 ĐỀ CHÍNH THỨC Nội dung Nhận biết Thông hiểu Vận dụng thấp Vận dụng cao Tổng TN TL TN TL TN TL TN TL Tính chất - ứng dụng của hiđrô -Biết tính chất hóa học của hiđrô là tính khử -Biết 1 số ứng dụng của hiđrô -Giải thích được cách thu khí hiđrô dựa vào tính chất vật lí của nó - Giải thích ứng dụng của hiđrô dựa vào tính chất của nó -Trình bày cách nhận biết khí hiđrô -Viết được PTHH thể hiện tính chất hóa học của hiđrô Số ý câu 2 câu 2 câu 1 câu 1ý 1ý,5câu Số điểm 1đ 1đ 1,5 đ 0,5 đ 4 đ - 40% Điều chế hiđrô – phản ứng thế -Biết nguyên liệu điều chế hiđrô trong phòng thí nghiệm. -Biết khái niệm phản ứng thế -Nêu hiện tượng khi đốt khí hiđrô -Nhận dạng được 1 phản ứng là phản ứng thế -Tính được khối lượng kim loại tạo thành trong phản ứng khử oxit kim loại của hiđrô - Viết PTHH điều chế hiđrô -Tính được thể tích hiđrô sinh ra -Xác định và tính được khối lượng chất còn dư sau phản ứng. Số ý câu 3 câu 1 câu 1 câu 1 ý 1 ý 2 ý, 5 câu Số điểm 2đ 0,5 đ 0,5 đ 2 đ 1đ 6đ -60% Tổng 5câu 3 đ - 30% 4câu 3 đ - 30% 1 câu, 2 ý 3 đ - 30% 1 ý, 1 đ - 10% 10câu, 3 ý 10đ-100% TRƯỜNG TH&THCS TRẦN PHÚ ĐỀ KIỂM TRA GGHKII HỌ VÀ TÊN: Môn: Hóa học 8 LỚP: ..SBD Thời gian: 45 phút Đề chính thức Năm học: 2022 - 2023 (Không kể thời gian phát đề) Điểm Chữ kí của GK Nhận xét của GV Chữ kí GT1 Chữ kí GT2 Bằng số Bằng chữ Phần A: Trắc nghiệm (5đ) I. Chọn các từ, cụm từ( khử , hợp chất , phản ứng thế, phản ứng hóa học, thay thế, đơn chất, nhường, chiếm ) điền vào chỗ trống cho phù hợp.(1,5đ ) 1...là phản ứng hóa học giữa ........................và hợp chất trong đó nguyên tử của đơn chấtnguyên tử của một nguyên tố trong......................... 2.Trong phản ứng với oxit kim loại hiđrô thể hiện tính vì nó ..................oxi của chất khác. II. Khoanh tròn chữ cái đứng đầu ý đúng nhất (3,5 đ) 1. Ứng dụng nào không có ở khí hiđrô? a. Sản xuất nhiên liệu c. Cung cấp cho bệnh nhân khó thở b. Hàn cắt kim loại d. Sản xuất phân đạm, amôniac 2. Phản ứng ở PTHH sau thuộc loại phản ứng gì? Fe + CuSO4 Cu + FeSO4 a. Hóa hợp c. Thế b. Phân hủy d. Hóa hợp và thế 3.Cho 7,2g FeO nung nóng tác dụng với khí H2 . Khối lượng sắt sinh ra sau phản ứng là: a. 7,2 g b.5,6 g c.4,4 g d. 3,6 g 4.Khí H2 được dùng để nạp vào khí cầu, bóng thám không vì: a. Khí H2 nhẹ nhất c.Có tính khử cao b. Khi cháy hiđrô tỏa nhiều nhiệt d.Ít tan trong nước 5. Hóa chất thường sử dụng để diều chế hiđro trong phòng thí nghiệm là: a. Zn và HCl b.Al và H 2SO4 (đặc ) c. Cu và HCl d.Zn và HNO3 (đặc) 6. Khi đưa que đóm đang cháy tới đầu dòng khí hiđrô tinh khiết hiện tượng xảy ra là: a. Nghe tiếng nổ lớn c. Hiđrô cháy với ngọn lửa màu tím b. Hiđrô không cháy, que đóm tắt d. Hiđrô cháy với ngọn lửa xanh nhạt 7. Ta có thể thu khí hiđrô bằng cách đẩy nước vì khí hiđrô : a. Không có màu c. Ít tan trong nước b. Là khí nhẹ nhất d. Không tan trong nước Phần B.Tự luận(5đ) Câu 1.(2 đ). Có 3 lọ mất nhãn đựng các khí riêng biệt sau: oxi, cacbonic, hiđrô. Hãy trình bày phương pháp nhận biết các khí trong mỗi lọ? Bài làm ........................ Câu 2 (3 đ) a. Cho 6,5g kẽm tác dụng với dung dịch axit clohiđric ( HCl) thu được khí hiđrô và muối kẽm clorua( ZnCl2). Tính thể tích khí hiđrô được sinh ra ( ở đktc) ? b. Nếu sử dụng thể tích khí hiđrô trên tác dụng với 12 g đồng(II)oxit nung nóng thì sau phản ứng chất nào còn dư và khối lượng hoặc thể tích còn dư là bao nhiêu? ( Cho Zn = 65 , H = 1, O = 16, Cu = 64) Bài làm ............................................ ĐÁP ÁN VÀ BIỂU ĐIỂM PHẦN A.TRẮC NGHIỆM (5đ) I. Điền từ, cụm từ thích hợp điền vào chỗ trống. Mỗi chỗ điền đúng 0,25 đ 1. thứ tự là: phản ứng thế, đơn chất, thay thế, hợp chất 2. thứ tự là: khử, nhường II. Khoanh tròn chữ cái đứng đầu ý đúng nhất. Mỗi ý đúng 0,5 đ Đáp án: Câu 1 2 3 4 5 6 7 Đáp án c c b a a d c B.Tự luận(5đ) Câu 1.(2 đ). - Đưa tàn que đóm còn than hồng vào miệng 3 lọ chứa khí. 0,25đ - Nếu thấy que đóm bùng cháy ở lọ nào thì lọ đó chứa khí oxi. 0,25đ - Que đóm ở 2 lọ còn lại không bùng cháy. 0,25đ - Dẫn lần lượt dòng khí ở 2 lọ còn lại đi qua CuO nung nóng. 0,25đ - Nếu thấy chất rắn mà khí nào đi qua bị đổi màu thí khí dẫn qua là khí Hiđrô 0,25đ - Khí ở lọ còn lại không làm que đóm bùng cháy và chất rắn không bị đổi 0,25đ màu là khí Cacbonic. PTHH: 2H2 + O2 tº 2H2O (2) 0,25đ H2 + CuO tº Cu + H2O (2) 0,25đ Câu 2 (3 đ) nZn = 6,5/ 65= 0,1 (mol) 0,25đ nCuO = 12/ 80 = 0,15 (mol) 0,25đ a/ Zn + 2HCl ZnCl2 + H2 (1) 0,25đ 1 mol 1mol 0,1 mol x (mol) 0,5đ Theo PT (1) ta có x = nH2 = 0,1 mol 0,25đ Thể tích khí hiđrô sinh ra là: 0,5đ VH2 = nH2 x 22,4 = 0,1 x 22,4 = 2,24 (lit) b/ H2 + CuO tº Cu + H2O (2) Lập tỉ lệ: nH2(đb) nH2(pt) 0,1 1 nCuO(đb) nCuO(pt) 0,15 1 0,25đ Dư CuO, H2 phản ứng hết H2 + CuO tº Cu + H2O (2) 1mol 1mol 0,1 mol y(mol) Theo PT (2) ta có y = nCuO(pư) = 0,1 (mol) 0,25đ Khối lượng CuO tham gia phản ứng là: m CuO(pư) = n CuO(pư) x MCuO= 0,1 x 80 = 8 (g) 0,25đ Khối lượng CuO còn dư là: m CuO(dư) = m CuO(bđ) - m CuO(pư) = 12 – 8 = 4 (g) 0,25đ V. Hoạt động dạy học 1. Ổn định lớp: Kiểm tra sĩ số 2. Kiểm tra sự chấp hành nội quy của học sinh 3. Phát đề và tính thời gian làm bài cho HS 4. Thu bài, kiểm tra tổng số bài làm 5. Dặn dò Soạn trước bài Dung dịch
Tài liệu đính kèm:
 de_kiem_tra_giua_hoc_ki_2_hoa_hoc_lop_8_nam_hoc_2020_2021.docx
de_kiem_tra_giua_hoc_ki_2_hoa_hoc_lop_8_nam_hoc_2020_2021.docx






